Nat Cell Biol | 全长GSDME通过非剪切方式诱导细胞焦亡
细胞焦亡(Pyroptosis)是由Gasdermin(GSDM)家族蛋白介导的程序性细胞坏死。近年来,大量的研究表明细胞焦亡与多种疾病相关,包括败血症、细菌感染、慢性炎症、自身免疫病、神经退行性疾病以及肿瘤等。
近日,一篇题为Full-length GSDME mediates pyroptosis independent from cleavage的文章发表在Nature Cell Biology上,从机制上阐释了全长GSDME通过剪切非依赖的方式诱导细胞焦亡的新通路。

该研究发现,当细胞被UVC照射后,线粒体发生断裂(mitochondrial fission),导致线粒体活性氧(mitoROS)提高,进而触发细胞色素c的过氧化物酶活性,氧化线粒体心磷脂,促进Lipid ROS的产生。Lipid ROS信号被GSDME直接感知,导致GSDME氧化多聚。与此同时,UVC照射导致的DNA损伤激活PARP1产生大量的PAR(Poly(ADP-ribose))并释放到胞浆,胞浆中的PAR则与PARP5结合,激活 PARP5活性,以此促进其与GSDME结合,诱导GSDME发生PARylation修饰,导致GSDME构象发生改变,解除GSDME-C端对其N端的自抑制状态,进而促进GSDME感知lipid-ROS信号。这两种不同的蛋白修饰协同作用导致了全长GSDME靶向质膜定位并打孔,从而诱导细胞焦亡。
基于这一新发现,研究团队进一步确定了全长GSDME介导的细胞焦亡不仅仅局限于UVC照射。同时激活PARP的活性和提高Lipid ROS水平的药物或者DNA损伤诱导剂和Lipid ROS诱导剂联合处理同样能够诱导全长GSDME依赖的细胞焦亡。
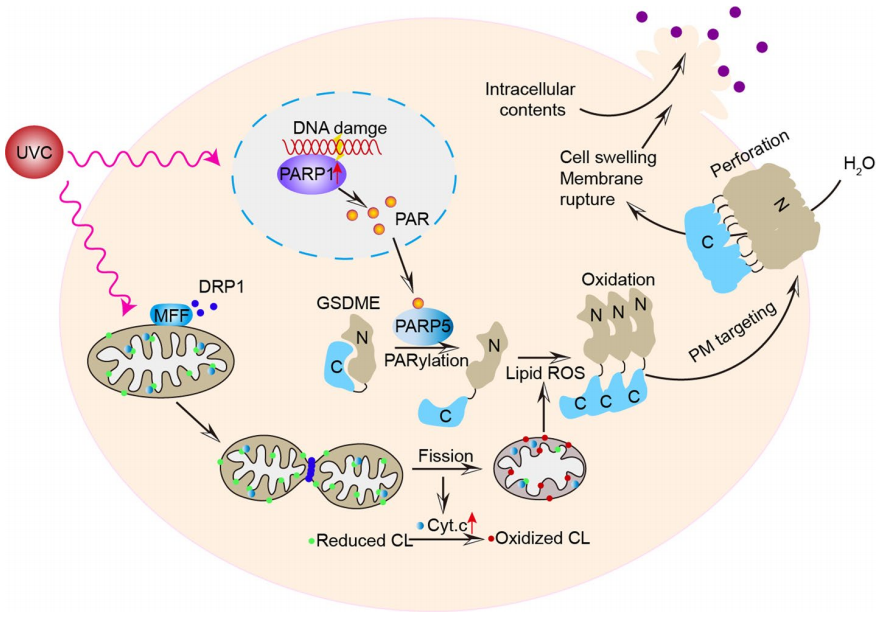
全长GSDME通过非剪切方式诱导细胞焦亡的信号网络和调控机制模式图
这一发现挑战了焦亡诱导需要蛋白酶剪切的传统概念,阐明了全长GSDME不依赖蛋白酶剪切诱导细胞焦亡的新机制及其调控模式,进一步证实了全长GSDME与GSDMD一样可以直接诱导细胞焦亡,为研究细胞焦亡的新范式奠定了理论基础。

