自组装的嵌合纳米抗体脂质体
近日,美国宾汉姆顿大学联合南京大学医学院附属鼓楼医院、南京融捷康生物科技有限公司、哈佛医学院共同在纳米科技领域国际顶级期刊《Nature Nanotechnology》(IF 38.3)上发表文章 “Chimeric nanobody-decorated liposomes by self-assembly”。报道了一种新型免疫脂质体制备方法,该方法的核心技术即是设计了能够自动组装到脂质体双分子层中的嵌合纳米抗体,实现了一步制备免疫脂质体。文章报道的免疫脂质体制备方案,直击当前化学修饰法的制备痛点,有望为免疫脂质体产业化带来质的飞跃。文章制备的靶向HER2的嵌合纳米抗体对癌细胞的杀伤提升显著,对小鼠肿瘤抑制效果和小鼠存活时间明显并显著延长了小鼠存活时间。为靶向药物递送和肿瘤临床提供了新思路。
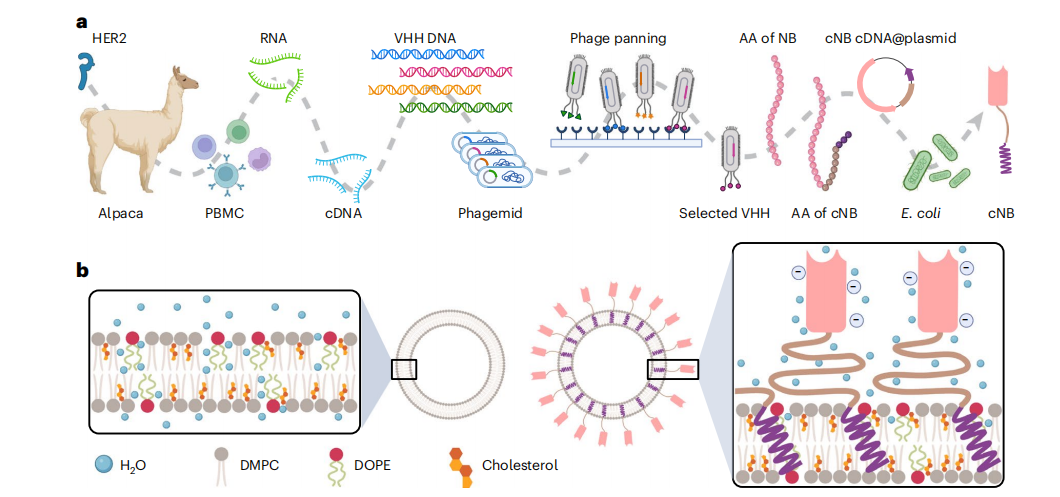
嵌合纳米抗体(cNB)由靶向人表皮生长因子受体2(HER2)的NB、柔性肽接头和人单跨膜结构域(STMD)组成。脂质、药物和 cNB 经一系列制备条件优化后能够高效率自动组装成高产量高纯度的免疫脂质体(cNB-LP)。研究显示,64 %的药物载荷,可以被包载到100 nm的脂质体中,并且在温和的条件下,将多达2500个cNBs锚定在脂质体膜上,而不受空间位阻的影响。其中靶向HER2纳米抗体的整合赋予了脂质体靶向性,纳米抗体因其同时具备高亲和力(可达pM级别)、高稳定性、低免疫原性和极小的尺寸(分子量仅为传统单克隆抗体十分之一),使免疫脂质体成功制备,助力载药脂质体成功靶向肿瘤细胞。
传统化学修饰法制备免疫脂质体因其繁杂的修饰导致制备成本非常昂贵,复杂的制备工艺导致有效载荷持续损失,多步骤制备条件严重影响靶向活性,批次间质量差异无法控制,目前产业化挑战仍未得到有效解决,因而免疫脂质体的大规模生产十分受阻,其应用价值的开发也十分有限。而自组装免疫脂质体制备原理是脂质体、药物载荷和嵌合纳米抗体基于其生物相容性的自动组装,该方案完决了当前化学修饰法制备的劣势,甚至有望基于目前生物制品生产管线直接进行大规模生产开发,显示出广阔的工业生产前景。

文章制备的cNB-LP在HER2过度表达细胞系中的抗肿瘤活性显著增强,治疗效果可分别提高3.3至13.6倍;在动物模型(SK-BR-3原位模型)实验中,cNB-LP组的肿瘤体积比两个对照组分别小3.5倍和1.7倍,cNB-LP和LP组的肿瘤重量比对照组分别轻8.6倍和4.6倍;。负载5FU的cNB-LP可将SK-BR-3荷瘤小鼠的中位生存时间从28天延长至56 天。此外,作者对NCI-N87皮下模型也进行了研究。载药cNB-LP处理的NCI-N87的肿瘤体积分别是三组对照组的10.4倍、5.6倍和1.6倍。该研究为靶向药物递送提供了新思路,有望在临床上应用于肿瘤治疗。
纳米抗体是新生赛道,基于其高亲和力高、高穿透力等优势,未来可广泛用于癌症治疗、检测、ADC、分子影像、核药等多个领域。
浏览查看更多请访问:https://www.nature.com/articles/s41565-024-01620-6

